Amonia ceria (IV) nitrato
| Amonia ceria (IV) nitrato | ||||

| ||||
| Kemia strukturo de la Amonia ceria (IV) nitrato | ||||

| ||||
| Oranĝokoloraj kristaloj de amonia ceria (IV) nitrato | ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 16774-21-3 | |||
| ChemSpider kodo | 157072 | |||
| PubChem-kodo | 16211559 | |||
| Fizikaj proprecoj | ||||
| Aspekto | oranĝo-ruĝaj kristaloj | |||
| Molmaso | 548,26 g mol−1 | |||
| Smiles | [Ce+4].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-]
[N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[NH4+].[NH4+] | |||
| Denseco |
| |||
| Fandopunkto | 107 ĝis 108 °C (225 ĝis 226 ℉; 380 ĝis 381 K) | |||
| Solvebleco |
| |||
| Sekurecaj Indikoj | ||||
| Risko | R8 R22 R36/37/38 | |||
| Sekureco | S17 S26 S36 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H272, H302, H314 | |||
| GHS Deklaroj pri antaŭgardoj | P221, P280, P301+330+331, P305+351+338, P308+310 | |||
Amonia ceria (IV) nitrato, ceria (IV) nitrato de amonio aŭ (NH4)2Ce(NO3)6 estas neorganika kombinaĵo, oranĝo-ruĝaj kristaloj, akvosolvebla ceria salo kaj specifa oksidiga reakcianto en organika sintezo krom norma oksidanto en kvanta kemia analizo.
Preparado, proprecoj kaj strukturo
[redakti | redakti fonton]
La anjono [Ce(NO3)6]2− generiĝa per dissolviĝo de la ceria oksido Ce2O3 en varme koncentrita HNO3. La salo konsistas je anjono [Ce(NO3)6]2− kaj paro da NH4]+. La amoniakjonoj ne partoprenas en la oksidigaj reakcioj de ĉi-salo. En la anjono ĉiu nitrata grupo kelatiĝas al ceriatomo laŭ dudenta[1] maniero. La anjono [Ce(NO3)6]2− poseda molekulan simetrion kaj la CeO12 difinas ian ikozedron. Ce4+ estas potenca unuelektrona oksidigagento. Rilate al ĝia forta redoksa potencialo, ĝi estas eĉ pli oksidigagento ol Cl2 mem. Malmultaj stabilaj reakciantoj estas pli fortaj oksidantoj. En la redoksa procezo Ce(IV) konvertiĝas al Ce(III) signalita per malapero de la solvaĵo-koloro el oranĝokolora al flava (kondiĉe ke la substrato kaj produkto ne estu forte kolorigitaj).
Aplikoj en organika kemio
[redakti | redakti fonton]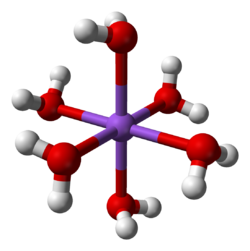
En organika sintezo, ACN utilas kiel oksidiganto al multaj funkciaj grupoj (alkoholoj, fenoloj kaj eteroj) samkiel al karbono-hidrogena ligiloj, specife tiuj apartenantaj al benzila radikalo [C6H5CH2-]. Alkenoj suferas dunitroksiligo, kvankam la estiĝo subiĝas al solvaĵo. Kinonoj estiĝas ekde la katekoloj kaj hidrokinonoj kaj eĉ nitroalkanoj oksidiĝas.
ACN uzatas por konverti para-metokso-benzila kaj 3,4-dumetoksobenzilaj eteroj, kiuj estas protektaj grupoj por alkoholoj. Du ekvivalentoj de ACN necesas por ĉiu ekvivalento de para-metokso-benzila etero. La alkoholo liberiĝas, kaj la para-metokso-benzila etero konvertiĝas al para-metokso-benzilaldehido. La balancita ekvacio estas la jena:
Literaturo
[redakti | redakti fonton]- Organic Chemistry Portal
- Sigma Aldrich[rompita ligilo]
- ACS Publications
- ReserchGate
- Avogadro Arkivigite je 2015-05-08 per la retarkivo Wayback Machine
- Chemical Book
- The International Pharmacopoeia, Volume 1, World Health Organization
- Vanadium Compounds—Advances in Research and Application: 2013 Edition ...
| ||||||









